Proteína resistente al mixovirus A (MxA)
El gen Mx se encontró en 1964 y recibió su nombre de su resistencia al mixovirus. Después de la infección viral, el gen Mx es inducido por el interferón-ifn de tipo I (α/β) para producir proteínas MxA y MxB. Ambos se distribuyen en el citoplasma.Las proteínas Mx son miembros de la familia de las GTPasas grandes y los jugadores del sistema inmunológico innato central.
Las proteínas MxA median la resistencia celular contra varios patógenos, incluidos los virus de la influenza y muchos otros virus relacionados. Las proteínas MxA pueden unirse a la cápside viral e inhibir la transcripción y traducción virales.Las proteínas MxA están estrechamente asociadas con la infección viral y pueden usarse para el diagnóstico temprano de la infección viral.

Productos resistentes A los mixovirus proteína A (MxA)
Estructura de las proteínas MxA
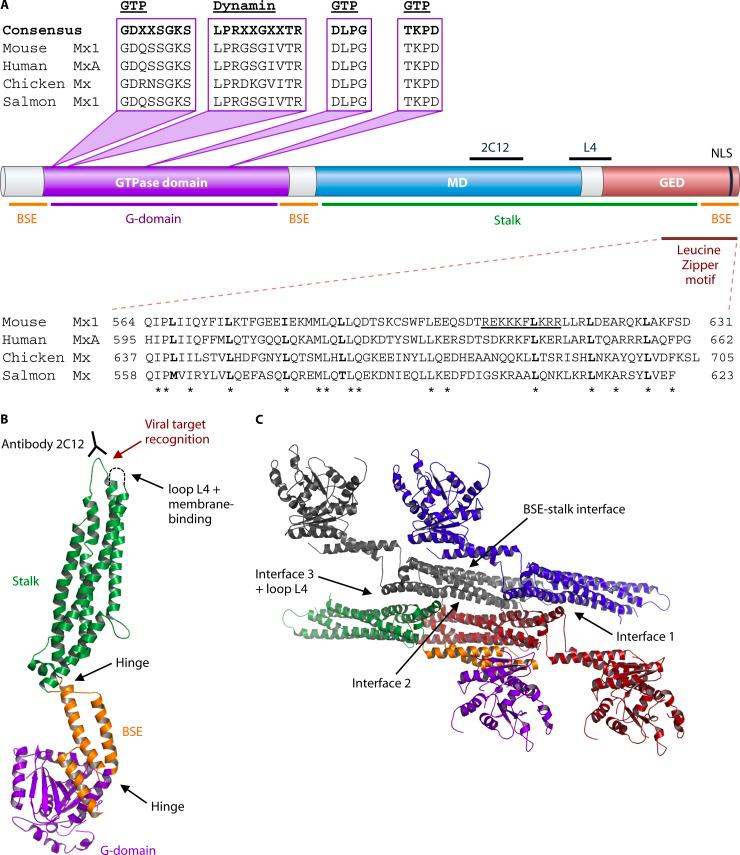
¿Cómo realizan las proteínas Mx sus funciones antivirales?
Se requiere un dominio GTPasa intacto para la actividad contra virus RNA, pero no está claro si la unión a GTP es suficiente o también se necesita actividad GTPasa. Como la estructura cristalina de MxA se basa en MxA libre de nucleótidos, Será interesante determinar los cambios conformacionales causados por la Unión GTP y la hidrólisis GTP en una proteína MxA enzimáticamente activa.
La información obtenida de la estructura cristalina de MxA, junto con los estudios mutacionales, condujo a la proposición de un mecanismo antiviral que depende del ensamblaje multimérico de las proteínas Mx. En este modelo, Mx forma tetrámeros QUE SE oligomerizan aún más en grandes anillos Mx a concentraciones más altas de Mx.
Estos anillos contienen dominios GTPasa en el exterior del anillo y tallos que apuntan hacia adentro. Este ensamblaje y oligomerización permiten que el tallo Mx interactúe con estructuras Diana víricas, por ejemplo, vRNPs, lo que posiblemente conduce a múltiples anillos Mx que se envuelven alrededor de estas estructuras. Los anillos Mx adyacentes pueden interactuar a través de sus dominios GTPasa, lo que conduce a una mayor actividad GTPasa. Esta conformación permite el cruce entre los dominios GTPasa y los tallos de las moléculas Mx vecinas y provoca cambios conformacionales que conducen a la constricción de los anillos Mx y la interrupción de los vRNPs virales funcionales por un ciclo mechano-químico. De esta manera, los anillos Mx podrían interrumpir la asociación de complejos de nucleoproteínas con la polimerasa viral, inhibiendo así la transcripción o replicación del virus.
Estos anillos Mx también podrían actuar para relocalizar nucleoproteínas virales (ribo) o proteínas de la cápside (nucleo) en complejos perinucleares de una manera dependiente de la GTPasa, lo que lleva a su secuestro y/o degradación. Aunque este modelo de formación de anillos es muy atractivo, no hay pruebas de que realmente se produzca la formación de anillos de Mx alrededor de vRNPs u otras estructuras virales.
- Marcadores cardiacos
-
Marcador de Tumor
- CA50
- CA125
- CA242
- CA15-3
- CA19-9
- CA72-4
- Pepsinogens (IGP)]
- Epididimo humano 4 (HE4)
- Antígeno prostático específico (PSA)
- Carcinoma de células escamosas (SCC)
- Enolasa específica de neuronas (NSE)
- Citoqueratina 19 fragmento (CYFRA21-1)
- Péptido Liberador de progastrina humana (ProGRP)
- Proteína inducida por ausencia de vitamina K o antagonista-II (PIVKA II)
- Marcador inflamatorio
-
Enfermedad infecciosa
-
COVID-19
- Proteína ACE2-His recombinante
- COVID-19 recombinante RBD-su proteína
- COVID-19 recombinante Pico 1 Proteína de longitud completa
- COVID-19 recombinante espiga 1 su proteína de longitud completa
- COVID-19 recombinante espiga 1 mFc Proteína de longitud completa
- Proteína ACE2-hFc humana recombinante
- Proteína ACE2-mFc humana recombinante
- Antígeno de espiga recombinante (RBD)
- Antígeno nucleocápside recombinante
- Ratón Anti-humano COVID-19 Nucleocapsid mAb
- COVID-19 humanizado Anti-humano mAb IgG proteína N
- COVID-19 humanizado Anti-humano mAb IgM proteína N
- Proteína humanizada Anti-COVID-19 humana mAb IgG S
- Proteína humanizada Anti-COVID-19 humana mAb IgM S
- Anticuerpo Anti-humano COVID-19 RBD humanizado (Control)
- VIH
- Influenza (gripe)
- El Dengue
- Monkeypox
-
COVID-19
- Hormonas
- Función tiroidea
- Metabolismo de la glucosa
- Marcador de hueso
- Anticuerpo secundario
- Reactivo bloqueador heterófilo